
- A
- A
- A
- A
- A
- A
- Нормальный
- Увеличенный
- Большой
"Синдром обкрадывания" селезеночной артерией после ортотопической трансплантации печени
Загайнов В.Е.1-2, Серегин А.А.1, Зайцев А.И.1, Вельский В.А.1, Рыхтик П.И.1,
Заречнова Н.В.1, Васенин С.А.1, Рябова Е.Н.1, Горохов Г.Г.1, Шкалова Л.В.1
1 ФГУ "Приволжский окружной медицинский центр ФМБА России", г. Нижний Новгород
2 ГОУ ВПО "Нижегородская медицинская академия" Росздрава, кафедра хирургии факультета обучения иностранных студентов, г. Нижний Новгород
Статья поступила в редакцию 25.03.11 г.
Контакты: Васенин Сергей-Андреевич, к.м.н., зав. отделением трансплантации ФГУ "Приволжский окружной медицинский центр ФМБА России", г. Нижний Новгород.
Тел. 8-831-421-69-74, e-mail: sergvasenin@yandex.ru

Одним из вариантов артериальных осложнений после ортотопической трансплантации печени является синдром обкрадывания селезеночной артерии. В материале представлен собственный опыт диагностики и лечения этого состояния. В каждом наблюдении удалось достаточно своевременно заподозрить патологический синдром на основании инструментальных и лабораторных данных и подтвердить диагноз при ангиографии. Успешная коррекция выполнена путем различных вариантов эмболизации селезеночной артерии.
Ключевые слова: трансплантация печени, синдром обкрадывания, эмболизация селезеночной артерии.
Грозным осложнением ортотопической трансплантации печени является тромбоз артерии трансплантата. Причины тромбоза артерии могут быть технические, связанные с нарушением свертывающей системы крови, обусловленные плохим качеством трансплантата. Однако существуют и более редкие причины артериальной дисфункции, связанные с функциональными особенностями висцерального кровотока в условиях сформированной длительной портальной гипертензии.
Синдром обкрадывания селезеночной артерией (в англоязычной литературе - splenic artery steal syndrome - SASS) - патологическое состояние, осложняющее ортотопическую трансплантацию печени в 1-4% случаев [8]. Проявляется в перераспределении кровотока от чревного ствола преимущественно в селезеночную или желудочно-двенадцатиперстную артерию в сроки от 2 до 5 сут после операции. В результате снижаются линейные и объемные показатели кровотока в печеночной артерии с развитием артериальной ишемии трансплантата, вплоть до ее тромбоза. Регистрируются рост уровня печеночных ферментов и билирубина, изменения показателей кровотока по печеночной артерии и воротной вене, определяемые при УЗДГ и КТ [1, 3, 5]. Опасным следствием синдрома обкрадывания может быть тромбоз печеночной артерии с последующей потерей трансплантата. Среди поздних осложнений описаны дисфункции желчного дерева [9].
Статистически значимыми факторами, предполагающими развитие синдрома обкрадывания селезеночной артерией, являются: размеры селезенки, диаметр селезеночной артерии более, 4 мм со снижением индекса ее резистентности, индекс соотношения диаметров селезеночной и печеночной артерий [4].
В то же время Quintini С. с соавт. (2008) считают основной причиной развития SASS портальную гиперперфузию трансплантата [10].
Своевременная диагностика достаточно грозного патологического синдрома является актуальной во избежание потери трансплантата. Среди методов лечения синдрома обкрадывания селезеночной артерией описаны лигирование селезеночной артерии, спленэктомия. Наиболее часто применяется эмболизация селезеночной артерии с возможной последующей спеленэктомией [6, 7]. Umeda Y. с соавт. (2008) и И.О. Руткин с соавт. (2010)предлагают профилактическое лигирование селезеночной артерии во время трансплантации [2, 11].
Материал и методы
Среди выполненных в ФГУ "ПОМЦ ФМБА России" с 2009 г. 17 ортотопических трансплантаций печени SASS встретился последовательно в 3 случаях (данные на март 2011 г.). В центре применяется стандартный протокол обследования реципиентов, находящихся в "листе ожидания". С целью контроля качества трансплантата рутинно применяется биопсия донорской печени на сохраненном кровотоке. Для трансплантации отбираются органы с уровнем стеатогепатоза не более 10%. Тем самым при стандартизованном процессе операции ортотопической трансплантации печени развитие SASS у 13, 14 и 15-го реципиента, по-видимому, явились статистическими проявлениями. Приводим клинические примеры.
Клинический пример № 1
Пациент К., 34 года, поступил в отделение трансплантации ФГУ "ПОМЦ ФМБА России" для выполнения ортотопической трансплантации печени (ОТП) по поводу болезни Вилъсона-Коновалова, печеночной формы на стадии цирроза печени, декомпенсированного, класса С по Чайлд-Пью, портальной гипертензии, варикозного расширения вен пищевода 3—4-й ст., осложненного неоднократными кровотечениями в анамнезе, спленомегалии, гиперспленизма, асцита в анамнезе. 28.11.10 выполнена операция - ортотопическая трансплантация печени от трупного донора. Операция прошла без технических особенностей. Обращал на себя внимание большой размер селезенки - 180 х 78 мм, диаметр селезеночной артерии составлял б мм.
В раннем послеоперационном периоде при динамическом УЗДГ-мониторинге отмечено прогрессивное снижение скорости кровотока по печеночной артерии и увеличение скоростей кровотоков по воротной вене и селезеночной артерии. Зарегистрирован неуклонный рост показателей цитолиза (табл. 1). В связи с нарастающим при динамическом наблюдении ускорением кровотока по воротной вене проводилась дифференциальная диагностика частичного пристеночного тромбоза воротной вены и синдрома обкрадывания селезеночной артерией.
На четвертые сутки, 02.12.10, была выполнена целиакография. Под местной анестезией катетеризирована правая бедренная артерия по методу Селъдингера. По проводнику Roadrunner катетер VS1 5F проведен в брюшной отдел аорты, произведена селективная катетеризация чревного ствола. Установлено, что основной сброс контраста происходит в селезеночную артерию. Печеночная артерия контрастироваласъ со значительным запаздыванием, движения контраста в артерии имели характерный "маятникообразный" характер. Портальная фаза движения контрастного вещества демонстрировала неизмененную воротную вену, что исключало ее тромбоз. При дальнейшем продвижении катетера и суперселективном контрастировании печеночной артерии контраст заполнял печеночное артериальное дерево. Был диагностирован SASS. Для редукции селезеночного кровотока выполнена эмболизация.верхнеполюсной сегментарной ветви селезенки 3 эмболизационными спиралями IMWCE "Cook", диаметром 8 мм, длиной 5 мм. Контрольная целиакография продемонстрировала существенное улучшение кровотока по печеночной артерии, хорошее заполнение внутрипеченочного артериального дерева. Немедленно выполненная УЗДГ сосудов брюшной полости показала снижение кровотока по селезеночной артерии практически вдвое и увеличение скорости кровотока по печеночной артерии. Изменение индекса резистентности в печеночной артерии стало регистрироваться только через 8 часов после процедуры.
Таблица 1
Динамика лабораторных и инструментальных параметров пациента К.
| Дата | 29.11.10 | 30.11.10 | 01.12.10 | 02.12.10* | 03.12.10 | 05.12.10 | 15.12.10 |
| V ВВ, м/с | 0,7 | 0,8 | 0,9 | 1,5 | 0,6 | 0,7 | 0,57 |
| V ПА, м/с | 0,5 | 0,45 | 0,4 | 0,4 | 0,55 | 0,5 | 0,55 |
| Селезенка, мм | 178/75 | 175/69 | 173/67 | 179/67 | 175/63 | 169/65 | 168/68 |
| V СА, м/с | 1,0 | 1,2 | 1,0 | 0,9 | 0,8 | 1,0 | 1,0 |
| ACT, Ед./л | 1685 | 2997 | 1602 | 2071 | 702 | 234 | 27 |
| АЛТ, Ед./л | 1467 | 1918 | 1874 | 2010 | 596 | 117 | 32 |
| ЛДГ, Ед./л | 7472 | 7882 | 1478 | 1856 | 1008 | 321 | 230 |
| Общий билирубин, мкмоль/л | 47 | 87 | 57 | 59 | 47 | 41 | 37 |
Примечание. * - дата эмболизации селезеночной артерии.
Клинические проявления постэмболизационного синдрома в виде умеренной болезненности в левом подреберье постепенно купировались в течение 8 сут. Пациент выписан из клиники 24.12.10 в удовлетворительном состоянии. Наблюдается в амбулаторном центре трансплантации органов ФГУ "ПОМЦ ФМБА России" по настоящее время. Проводится двухкомпонентная схема иммуносупрессии: такролимус + микофенолаты. При контрольных УЗИ+УЗДГ 26.01.11: размер трансплантата - правая доля 140 мм, левая доля 100 мм, паренхима однородная; диаметр воротной вены (ВВ) 12,6 мм, скорость кровотока по ВВ 0,46 м/с. Печеночная артерия (ПА) 5 мм, скорость кровотока по ПА 0,4 м/с, ИР 0,69. Печеночные вены HVI. Диаметр холедоха 6 мм. Селезенка 170 X 78 мм. Время акселерации селезеночной артерии (СА) 0,09 с. Асцита нет. В биохимических анализах крови сохраняется умеренное повышение билирубина до 30 мкмоль/л за счет непрямой фракции, дополнительной терапии по этому поводу не получает.
Клинический пример № 2
Пациентка Е., 42 года, госпитализирована в отделение трансплантации ФГУ "ПОМЦ ФМБА России" для выполнения ортотопической трансплантации печени (ОТП) поводу первичного билиарного цирроза печени, класс С по Чайлд-Пъю, в стадии декомпенсации, портальной гипертензии, варикозного расширения вен пищевода III ст., осложненного кровотечением в анамнезе, спленомегалии, асцита. 07.12.10 выполнена операция - ортотопическая трансплантация печени от трупного донора. Исходно отмечалось увеличение селезенки в размерах до 18 см в длиннике, диаметр селезеночной артерии составлял 5 мм.
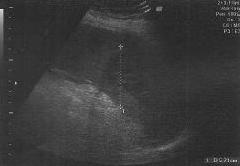
В послеоперационном периоде на третьи сутки при УЗДГ-мониторинге (рис. 1, 2) отмечено снижение скорости кровотока по печеночной артерии и увеличение скоростей кровотока по воротной вене и селезеночной артерии (табл. 2).
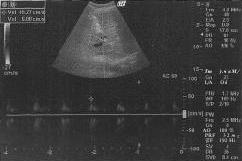
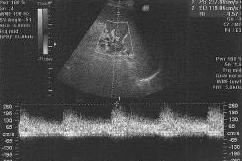
скорости
09.12.10 выполнена целиакография. Основанием для проведения исследования послужила отрицательная динамика лабораторных показателей цитолиза, резкое прогрессивное снижение скорости кровотока по печеночной артерии до 0,45 м/с.
Таблица 2
Динамика лабораторных и инструментальных показателей пациентки Е. 42 лет
| Дата | 07.12.10 | 08.12.10 | 09.12.10* | 10.12.10 | 11.12.10 | 14.12.10 | 17.12.10 | 30.12.10 |
| V ВВ, м/с | 0,7 | 0,6 | 0,8 | 0,4 | 0,5 | 0,6 | 0,4 | 0,57 |
| V ПА, м/с | 0,5 | 0,8 | 0,45 | 0,4 | 0,45 | 0,5 | 0,5 | 0,65 |
| Селезенка, мм | 155/48 | 154/46 | 150/45 | 158/68 | 157/67 | 160/60 | 160/60 | 180/69 |
| V СА, м/с | - | - | 1,2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| ACT, Ед./л | 759 | 445 | 1392 | 478 | 559 | 26 | 25 | 40 |
| АЛТ, Ед./л | 499 | 489 | 1503 | 1178 | 710 | 23 | 56 | 25 |
| ЛДГ, Ед./л | 1826 | 1190 | 1364 | 787 | 559 | - | - | - |
Примечание. * - эмболизация селезеночной артерии.
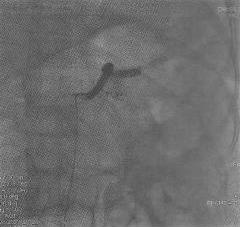
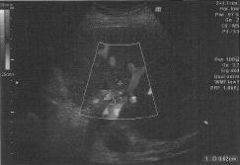
При ангиографии хорошо визуализировались селезеночная и левая желудочная артерии, общая печеночная артерия не контрастироваласъ (рис. 3).
Выполнена суперселективная катетеризация общей печеночной артерии. Определяется слабое маятникообразное продвижение контрастного вещества по правой и левой печеночной артериям, "обеднение" внутрипеченочного артериального русла. Желудочно-двенадцатиперстная артерия не визуализируется(рис. 4).
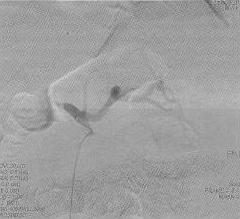
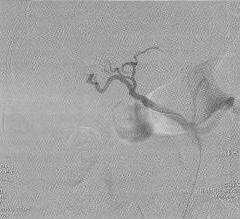
Учитывая данные ЦДК, ангиографическую картину, ситуация расценена как SASS. Решено выполнить эмболизацию селезеночной артерии спиралями. В селезеночную артерию через катетер введены 3 эмболизационные спирали IMWCE "Cook" диаметром 8 мм, длиной 5 мм.
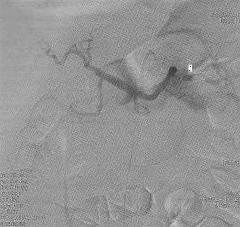
Две спирали установлены в области ворот селезенки, третья спираль фиксирована в среднем сегменте артерии (рис. 5).
При контрольной ангиографии селезеночной артерии кровоток по селезеночной артерии дистальнее спиралей не определяется (окклюзия ствола селезеночной артерии) (рис. 6).
При контрольной ангиографии чревного ствола визуализируется окклюзия селезеночной артерии, значительно усилился кровоток по печеночной артерии до уровня долевых ветвей, контрастируется a. gastroduodenalis (рис. 7). Определяется значительный сброс контраста в левую желудочную артерию.
В постэмболизаиионном периоде зарегистрирована положительная лабораторная и УЗ-картина (рис. 8.), однако сохранялось желчеистечение до 200 мл по улавливающему дренажу, появились перитонеальные симптомы.
* 13.12.10. - релапаротомия, декомпрессионное дренирование общего желчного протока по Холстеду в связи с подтеканием желчи между швами билиарного анастомоза.
На 5-е сут после эмболизации при УЗ-контроле отмечено появление гипоэхогенной зоны до 6 х 4 см в верхнем полюсе селезенки, которая увеличивается до 6 х 10 см к 14-м сут. На 11-е сут. - появление незначительного асцита. С 15-х сут. зафиксировано появление множественных гиподенсных зон по всей паренхиме селезенки (рис. 9).
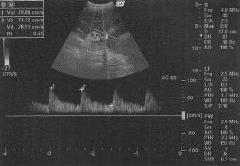
22.12.10 на основании СКТ и УЗИ брюшной полости установлен диагноз инфаркта селезенки. С 19-х сут после эмболизации у пациентки начинается длительный период фебрильной лихорадки с периодическими ознобами. Проводится массивная антибактериальная терапия - цефотаксим, метрогил, ванкомщин, еульперазон, меронем, тазоцин. Лабораторно отмечается лейкоцитоз, при этом печеночные ферменты и билирубин в норме, умеренный холестаз. Повышены уровни прокалъцитонина и С-реактивного белка, в посевах крови микроорганизмов не выявлено.
Период лихорадки продолжался в течение 3 нед. с тенденцией к постепенному снижению температуры. На 33-и сут отменены все антибактериальные препараты, температура постепенно нормализуется.
При контрольной СКТ брюшной полости 11.01.11 селезенка увеличена в объеме (максимальные размеры 171 х 93 х 186 мм), отмечается увеличение площади гиподенсных очагов и уменьшение объема неизмененной паренхимы. Свободной жидкости в брюшной полости нет.
Пациентка выписана из клиники 19.01.11 в удовлетворительном состоянии с нормальной температурой тела. Наблюдается в амбулаторном центре трансплантации органов ФГУ "ПОМЦ ФМБА России" по настоящее время. Используется двухкомпонентная схема иммуносупрессии: такролимус + микофенолаты. При контрольном УЗ-исследовании 02.02.11: размер трансплантата - правая доля 138 мм, левая доля 68 мм, паренхима однородная. Диаметр воротной вены (ВВ) - 11 мм, скорость кровотока по ВВ - 0,22 м/с. ПА - 6 мм, скорость кровотока по ПА - 0,7 м/с, ИР - 0,68. Печеночные вены HV0 (рис. 10). Диаметр холедоха 7,2 мм. Селезенка 210 X 80 мм, зона разряжения после инфаркта - без динамики. Асцита нет. В биохимических анализах крови нормализовались уровень лейкоцитов, билирубин, печеночные ферменты. Сохраняется умеренный холестаз — щелочная фосфатаза 293 Ед./л, гамма-ГТП 59 Ед./л, С-реактивный белок 29 ме/л.
Клинический пример № 3
Пациент К. 33 лет поступил в отделение трансплантации ФГУ "ПОМЦ ФМБА России" для выполнения ортотопической трансплантации печени по поводу цирроза печени смешанной этиологии (HCV + токсической), класса С по Чайлд-Пъю, в стадии декомпенсации, портальной гипертензии, варикозного расширения вен пищевода III ст., спленомегалии, гиперспленизма, асцита в анамнезе.
В октябре 2010 г. начата противовирусная терапия гепатита С короткими интерферонами. С ноября 2010 г. РНК вируса гепатита С в крови не определяется.
13.01.11 выполнена операция - ортотопическая трансплантация печени от трупного донора. Ход операции — без особенностей. Размеры селезенки — 20 см в длиннике.
В первые сутки через 1,5 ч после трансплантации лабораторно отмечается снижение печеночных ферментов, по данным УЗДГ-мониторинга, скорость кровотока по ВВ - 0,56 м/с, скорость в ПА - 0,52 м/с, размер селезенки - 160/60 мм. Через сутки после операции при УЗДГ брюшной полости зарегистрирован рост портального кровотока до 0,78 м/с, обеднение кровотока по печеночной артерии до 0,34 м/с. Лабораторно рост ACT с 842 до 1421 Ед./л, АЛТ - с 304 до 605 Ед./л, ЛДГ - с 3910 до 2889 Ед./л. Клинически - нарастающая печеночная энцефалопатия. Заподозрен третий подряд (?!) синдром обкрадывания селезеночной артерией. 14.01.11 выполнена целиакография, при которой отмечено обеднение артериального русла трансплантата с характерным "маятникообразным" движением контрастного вещества, быстрый сброс всего контрастного вещества в селезеночную артерию. Учитывая значительное уменьшение размеров селезенки в раннем послеоперационном периоде, произведена "мягкая" эмболизация мелких ветвей селезеночной артерии гемостатической губкой. После эмболизации достигнуто отчетливое контрастирование печеночной артерии до субсегментарных ветвей. Данные мониторинга после эмболизации представлены в табл. 3.
Таблица 3
Динамика лабораторных и инструментальных показателей пациента К. 33 лет
| Дата | 14.01.11 | 15.01.11 | 16.01.11 | 17.01.11 | 20.01.11. | 27.01.11 | 04.02.11 |
| V ВВ, м/с | 0,7 | 0,6 | 0,45 | 0,4 | 0,4 | 0,3 | 0,35 |
| V ПА, м/с | 0,3 | 0,3 | 0,65 | 0,45 | 0,69 | 0,5 | 0,42 |
| Селезенка, мм | 160/50 | 170/80 | 180/50 | 200/50 | 180/78 | 210/78 | 210/83 |
| V СА, м/с | 0,5 | 0,65 | 0,65 | 0,65 | 0,65 | 0,65 | 0,65 |
| ACT, Ед./л | 462 | 1220 | 316 | 128 | 69 | 13 | 15 |
| АЛТ, Ед./л | 275 | 560 | 323 | 190 | 127 | 12 | 9 |
| ЛДГ, Ед./л | 961 | 3296 | 1491 | 1514 | 1334 | 735 | 753 |
Лабораторно с первых суток после эмболизации отмечено постепенное снижение печеночных ферментов и полная их нормализация на 7-е сут. На 3-й сут после рентгенэндохирургического вмешательства при УЗИ-контроле зафиксировано появление гипоэхогенной зоны в нижнем полюсе селезенки с тенденцией к увеличению количества и размеров гипоэхогенных участков, асцит. На 12-е сут. начинается длительный период лихорадки до 37,8 °С в вечерние часы, проводилось консервативное лечение. Пациент выписан из клиники 18.02.11 в удовлетворительном состоянии при нормализации температуры тела. Наблюдается в амбулаторном центре трансплантации органов ФГУ "ПОМЦ ФМБА России" по настоящее время. Ведется на духкомпонентной схеме иммуносупрессии — циклоспорин + микофенолаты.
Обсуждение
В рассмотренном первом случае в раннем послеоперационном периоде у пациента имела место лабораторная картина ишемическо-реперфузионного повреждения трансплантата средней тяжести, которая на фоне проводимой интенсивной терапии купировалась к исходу 2-х послеоперационных суток. Повторный пик уровня ферментов зарегистрирован на 4-е сут при хорошем соматическом состоянии пациента. Основным диагностическим критерием была динамика показателей УЗДГ печеночных сосудов, в первую очередь резкое возрастание скорости кровотока по воротной вене и селезеночной артерии и снижение скорости по печеночной артерии с нарастанием индекса резистентности с 0,6 до 0,8-0,9. Это и позволило заподозрить развитие синдрома обкрадывания селезеночной артерией.
В приведенных втором и третьем клинических случаях отправной точкой для диагностики COCA также послужили данные УЗ-диагностики в виде увеличения скорости кровотока по воротной вене, уменьшения артериального притока к печени. Полученные ангиографические данные были схожими во всех рассматриваемых случаях. Лабораторные изменения последовали за ними с некоторым запозданием. Адекватная артериальная перфузия трансплантата была достигнута эмболизацией селезеночной артерии с последующим инфарктом и формированием кист в селезенке. Несмотря на длительную лихорадку, наличие гиподенсных очагов в селезенке, признаков гнойной инфекции не зарегистрировано. Сдержанная консервативная тактика ведения больных имела положительные результаты.
Связь развития синдрома обкрадывания селезеночной артерией с качеством трансплантированных органов не была прослежена. Во всех случаях МОЗ на основании смерти мозга у доноров со стабильной гемодинамикой, приемлемой лабораторной картиной. При гистологическом исследовании донорской печени (протокол клиники) жировой гепатоз не превышал 10%. Во всех случаях операция трансплантации печени выполнена по единой методике: кавакавальный анастомоз "конец в бок" с боковым отжатием НПВ реципиента без вено-венозного обхода, портальный и артериальный анастомозы "конец в конец" непрерывным швом, холедохохоледохоанастомоз "конец в конец" без наружного дренирования желчных протоков. Сопоставимы были длительность операции (220-240 мин), время агепатического периода (40 мин) и тепловой ишемии. Время холодовой ишемии во всех случаях не превышало 8 ч.
Достоверными критериями диагностики SASS, по нашим наблюдениям, являются:
- Нарастание уровня трансаминаз и ЛДГ с/без нарастанием цифр билирубина.
- Неуклонное увеличение скорости кровотока по воротной вене.
- Уменьшение, вплоть до исчезновения, скорости кровотока по печеночной артерии с/без нарастанием индекса резистентности.
Относительным признаком можно считать сохраняющийся размер селезенки в послеоперационном периоде.
В наших случаях ведущим методом первичной диагностики SASS была ультразвуковая доплерография. При подозрении на развивающийся синдром обкрадывания единственным методом окончательной верификации диагноза является целиакография, малоинвазивный и безопасный метод, даже на ранних сроках послеоперационного периода при сохраняющихся коагуляционных нарушениях. При подтверждении синдрома обкрадывания селезеночной артерией нам представляется оправданной тактика поэтапной эмболизации сегментарных ветвей селезеночной артерии, начиная от верхнего полюса, с оценкой изменений в печеночном кровотоке. Дискутабельным остается вопрос о целесообразности и показаниях к интраоперационной перевязке селезеночной артерии.
Полученный нами опыт свидетельствует о необходимости иметь в арсенале центров, занимающихся трансплантацией печени, возможность экстренной ангиографической диагностики и интервенционной коррекции возникающих нарушений.
Синдром обкрадывания селезеночной артерией после ортотопической трансплантации печени является грозным и потенциально опасным осложнением, поэтому актуально дальнейшее накопление и систематизация опыта диагностики и лечения этого патологического состояния.
Cписок литературы
- Донова Л.В., Андрейцева О.К, Журавель С.В., Чжао А.В. Значение комплексного УЗИ в диагностике недостаточности кровоснабжения печеночного трансплантата // Анналы хирургической гепатологии. - 2009. - № 3. - С. 13.
- Руткин И. О., Таразов П.Г., ГрановД.А. и др. Возможности эмболизации селезеночной артерии в лечении "синдрома обкрадывания" после ортотопической трансплантации печени // Трансплантология. - 2010. - № 1. - С. 26-29.
- Garcia-Criado A., Gilabert R., Berzigotti А., Вгй С. Doppler Ultrasound Findings in the Hepatic Artery Shortly After Liver Transplantation // Journal of Ultrasound in Medicine. - 2009. - Vol. 28. - P. 471-477.
- Grieser C, Denecke Т., Steffen I.G. et al. Multidetector computed tomography for preoperative assessment of hepatic vasculature and prediction of splenic artery steal syndrome in patients with liver cirrhosis before transplantation // Eur. Radiol. - 2010. - Jan. (Vol. 20 (1)). - P. 108-117.
- Kirbasal, Ulua E.M.K., OzturkaA. et al. Multidetector Computed Tomographic Angiography Findings of Splenic Artery Steal Syndrome in Liver Transplantation // Transplantation proceedings. - May 2007. - Vol. 39. Issue 4. - P. 1178-1180.
- Hanger R., Hanger M., Neuhaus P. et al. Splenohepatic and gastroduodenal steal syndrome in liver transplant recipients // AJR. - 2009. - Vol. 193. - P. 128-135.
- Madoff D., Denys A., Wallace M.J. et al. Splenic Arterial Interventions: anatomy, indications, technical considerations, and potential complications // RadioGraphics. - 2005. - Vol. 25. - S.191-211.
- Mogl M.T., Nussler N.C., Presser S.J. et al. Evolving experience with prevention and treatment of splenic artery syndrome after orthotopic liver transplantation // Transpl. Int. - 2010. - Aug. (Vol. 23 (8)). - P. 831-841.
- Sanyal R., Shah S.N. Role of Imaging in the Management of Splenic Artery Steal Syndrome // Journal of Ultrasound in Medicine. - 2009. - Vol. 28. - P. 471^77.
- Quintini C, Hirose K., Hashimoto K. et al. "Splenic artery steal syndrome" is a misnomer: the cause is portal hyperperfusion, not arterial siphon // Liver Transpl. - 2008. - Mar. (Vol. 14 (3)). - P. 374-379.
- Umeda Y, Yagi Т., Sadamori H. et al. Effects of prophylactic splenic artery modulation on portal overpermsion and liver regeneration in small-for-size graft // Transplantation. - 2008. - Vol. 86 (5). - P. 673-680.
