- A
- A
- A
- A
- A
- A
- Нормальный
- Увеличенный
- Большой
Cовременный подход к выбору сроков эндобилиарного протезирования у больных механической желтухой опухолевого генеза
Б.Х. Калаханова, аспирант кафедры хирургии1;
Г.М. Чеченин, к.м.н., доцент кафедры хирургии1; врач-хирург 50-го хирургического отделения (отделения хирургии печени и поджелудочной железы)2;
С.С. Лебедев, к.м.н., доцент кафедры хирургии1; врач-хирург 50-го хирургического отделения (отделения хирургии печени и поджелудочной железы)2;
Ю.В. Баринов, к.м.н., доцент кафедры хирургии1; врач-хирург 50-го хирургического отделения (отделения хирургии печени и поджелудочной железы)2;
А.А. Серегин, зав. отделением рентгенохирургических методов диагностики и лечения3;
Г.Г. Мелконян, к.м.н. ассистент кафедры хирургии1;
Р.Б. Мумладзе, д.м.н., профессор, зав. кафедрой хирургии1.
1 Российская медицинская академия последипломного образования, Москва, 123995, ул. Баррикадная, 2/1;
2 Городская клиническая больница им. С.П. Боткина, Москва, 125284, 2-й Боткинский пр., 5;
3 Приволжский окружной медицинский центр Федерального медико-биологического агентства России, Н. Новгород, 603005, Нижне-Волжская набережная, 2.
Цель исследования — на основании сравнительного анализа определить оптимальные сроки эндобилиарного стентирования у пациентов с синдромом механической желтухи опухолевого генеза.
Материалы и методы. Проанализированы результаты лечения 360 пациентов с синдромом механической желтухи опухолевой этиологии с применением миниинвазивных технологий. Средний возраст составил 60,0±8,3 года (от 37 до 84 лет). Первым этапом лечения была декомпрессия желчных путей с помощью чрескожного наружного дренирования протоков, вторым — восстановление проходимости желчных протоков и антеградного пассажа желчи с помощью технологии чрескожного стентирования. 1-ю группу составили 150 пациентов, у которых применена технология раннего стентирования, 2-ю — 210 больных, которым выполнено отсроченное стентирование желчных путей.
Результаты. Выделены три группы осложнений: связанные с манипуляцией, воспалительные осложнения и прогрессирование печеночной недостаточности. В 1-й группе осложнения наблюдались у 23 из 150 пациентов (15,3%), во 2-й группе — у 44 из 210 больных (21,9%) (p=0,039). Летальность в ближайшем послеоперационном периоде составила в 1-й группе 2,6%, во 2-й — 4,8% (p=0,038). В 1-й группе наблюдалось значительное и статистически значимое улучшение некоторых лабораторных показателей.
Заключение. Наиболее эффективным и безопасным вариантом помощи пациентам с механической желтухой опухолевого генеза является технология раннего стентирования — в первые трое суток после наружного чрескожного дренирования желчных путей.
Ключевые слова: эндопротезирование желчных путей; дренирование желчных путей; механическая желтуха опухолевого генеза.
Синдром механической желтухи объединяет достаточно большую группу заболеваний, общим признаком которых является развитие непроходимости магистральных желчных путей. Наиболее частая причина этих заболеваний — первичные и метастатические опухоли гепатобилиарной зоны (30,2–67,3% пациентов) [1–3]. Возникающая гипертензия в желчных путях, отсутствие желчи в кишечнике приводят к развитию воспалительных изменений билиарного тракта, а поступление элементов желчи в кровь вызывает интоксикацию и развитие тяжелых морфофункциональных нарушений паренхимы печени, почек и других органов и систем [4, 5]. В этих условиях наиболее эффективным и безопасным вариантом помощи больным механической желтухой опухолевого генеза является малоинвазивная декомпрессия желчных путей, которая значительно снижает интоксикацию и уменьшает риск развития полиорганной недостаточности [6–8]. Наиболее часто применяют наружное дренирование желчных путей [9, 10]. Однако эта методика не восстанавливает нормальный пассаж желчи и сопряжена с рядом прогнозируемых осложнений: развитием острой печеночной недостаточности по причине синдрома «быстрой декомпрессии»; диспротеинемией, активацией кишечного эндотоксина, нарастанием интоксикационного синдрома, обусловленного отсутствием желчи в просвете кишечника, и другими патофизиологическими механизмами [9, 11, 12]. Современным методом восстановления пассажа желчи является билиарное протезирование (стентирование), однако вопрос о сроках его применения требует уточнения и обоснования [13–15]. Одни авторы предлагают производить его одномоментно с дренированием желчного протока, другие — отсроченно, не ранее 4–5 сут после купирования механической желтухи [14–16].
Цель исследования — определить оптимальные сроки эндобилиарного стентирования у пациентов с синдромом механической желтухи опухолевого генеза.
Материалы и методы. В исследование включено 360 больных с опухолями гепатобилиарной зоны, у которых развился синдром механической желтухи, из них женщин — 200 (55,6%), мужчин — 160 (44,4%). Средний возраст составил 60,0±8,3 года (от 37 до 84 лет).
Всем пациентам проведено клиникоинструментальное исследование, включавшее физикальное обследование, ультразвуковое (аппарат Logiq Eq, General Electric, США), магнитнорезонансное исследование (аппарат Signa Excite HD 1,5Т, General Electric) и/или компьютерную томографию (аппарат Light Speed, General Electric).
Данное ретроспективное исследование было одобрено Этическим комитетом РМАПО и соответствует требованиям Хельсинкской декларации (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)). Все пациенты дали письменное информированное согласие для научного анализа их данных.
Диагноз верифицирован гистологически у всех пациентов. Самой частой причиной механической желтухи явилась опухоль поджелудочной железы у 228 из 360 больных (63,3%). Метастатическое поражение печени диагностировано у 54 пациентов (15%), опухоль Клацкина — у 42 (11,7%), опухоль большого дуоденального соска — у 30 (8,3%), рак общего желчного протока — у 6 (1,6%). Длительность заболевания составила в среднем 1,2±0,4 года (от 3 мес до 2 лет).
Первым этапом стала декомпрессия желчных путей с помощью чрескожного наружного дренирования протоков, вторым — восстановление проходимости желчных протоков и антеградного пассажа желчи методом чрескожного стентирования. Вмешательство проводили на рентгеновской установке ОЕС 9800 Plus (General Electric, США). Использовали нитиноловые саморасширяющиеся стенты (Taewoong Medical, Южная Корея) диаметром от 6 до 10 мм.
В зависимости от примененной технологии вмешательства пациенты были разделены на две группы (разделение проводили методом «конвертов»). В 1ю группу вошли 150 больных, которым стентирование желчных протоков выполнили в первые трое суток после наружной холангиостомии (технология раннего стентирования), в том числе одномоментное дренирование и стентирование провели 60 из 150 больных (16,7%). 2ю группу составили 210 пациентов, которым стентирование желчных протоков выполнили через 7–21 сут после наружного дренирования (технология отсроченного стентирования).
Большинство показателей больных обеих групп статистически значимо не отличались между собой (табл. 1), что дало основание оценить группы как однородные и сопоставимые и провести сравнительный анализ результатов лечения.
Таблица 1
Характеристики пациентов изучаемых групп
| Показатель | 1-я группа (n=150) | 2-я группа (n=210) | p |
| Возраст, лет (M±m) | 57,4±2,0 | 58,2±2,0 | 0,774 |
| Количество мужчин, абс. число/% | 68/45,3 | 92/43,8 | 0,876 |
| Длительность заболевания, лет (M±m) | 1,2±0,4 | 1,2±0,4 | 0,743 |
| Продолжительность синдрома механической желтухи до поступления, сут (M±m) | 7,0±1,0 | 9,0±1,0 | 0,773 |
| Локализация поражения, абс. число/%: опухоль головки поджелудочной железы опухоль большого дуоденального соска рак общего желчного протока опухоль Клацкина метастатическое поражение печени | 96/64,0 13/8,7 2/1,3 17/11,3 22/14,7 | 132/62,8 17 /8,9 4/1,9 25/11,9 32/15,2 | 0,867 0,934 0,975 0,963 0,745 |
| Уровень билирубина крови, мкмоль/л (M±m) | 152,0±5,0 | 156,0±5,0 | 0,874 |
| Число пациентов (абс. число/%) с уровнем билирубина крови (мкмоль/л): менее 60 от 60 до 200 более 200 | 6/4,0 47/31,3 97/64,7 | 11/5,3 64/30,4 135/64,3 | 0,882 0,921 0,971 |
| Аспартатаминотрансфераза, ЕД/л (M±m) | 95,0±2,0 | 98,0±2,0 | 0,768 |
| Аланинаминотрансфераза, ЕД/л (M±m) | 87,0±2,0 | 89,0±2,0 | 0,875 |
| Креатинин, мкмоль/л (M±m) | 56,0±1,0 | 62,0±1,0 | 0,723 |
| Мочевина, ммоль/л (M±m) | 3,7±1,0 | 4,2±1,0 | 0,134 |
Результаты и обсуждение. Время работы рентгеновской трубки при выполнении этапа стентирования в 1й и 2й группе составило 12,2±6,2 и 15,6±8,0 мин соответственно (p=0,871), общее время операции — 44,0±10,0 и 47,0±13,2 мин соответственно (p=0,873). Статистически значимых различий между группами по этим параметрам не отмечено.
У пациентов 1й группы в первые трое суток после стентирования по дренажному катетеру наружу выделялось в среднем 500±100 мл желчи в сутки (от 100 до 800 мл), у пациентов 2й группы — 1200±200 мл (от 600 до 3000 мл); p=0,046.
Необходимость перорального приема желчи в 1й группе была у 26 пациентов (17,3%), во 2й — у 78 (37,1%). В 1й группе по различным причинам не смогли принимать перорально собственную желчь 4 пациента (2,7%), во 2й группе — 28 (13,3%).
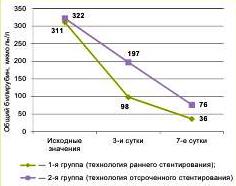
После вмешательства у пациентов 1й группы отмечено более быстрое снижение концентрации общего билирубина (см. рисунок). Различие статистически не значимо.
Осложнения после вмешательства диагностированы у 67 из 360 пациентов (18,6%) — всего 77 осложнений, что сопоставимо с результатами других авторов [8, 10, 14].

Выявлено, что у пациентов отмечался определенный спектр осложнений, которые мы объединили в три группы (табл. 2). В первую группу включены осложнения, непосредственно связанные с выполнением манипуляций (пункция и катетеризация протоков): правосторонний гидроторакс, местный желчный перитонит, формирование наружного желчного свища. Вторую группу составили воспалительные осложнения, а третью группу — состояния, которые характеризовали течение заболевания после стентирования: наличие или отсутствие прогрессирования недостаточности органов и систем. Следует отметить, что до настоящего времени нет единого мнения, как оценивать этот процесс: как осложнение или как естественное течение заболевания после процедуры [13, 15]. Мы склоняемся ко второму суждению, так как в ряде случаев даже после блестяще выполненной процедуры наблюдается прогрессирование полиорганной недостаточности (в основном печеночнопочечной в нашем исследовании), что, по всей видимости, обусловлено отсутствием резервов тканей печени к их морфофункциональному восстановлению.
Таблица 2
Оценка осложнений после раннего и отсроченного стентирования желчных протоков у изучаемых пациентов
| Характер осложнений | Количество осложнений, абс. число/% | р | |
| 1-я группа (n=150) | 2-я группа (n=210) | ||
| Осложнения, связанные с манипуляцией: правосторонний гидроторакс местный желчный перитонит наружный желчный свищ | 5/3,3 4/2,6 1/0,7 0 | 13/6,2 5/2,4 3/1,4 5/2,4 | 0,009 0,934 0,039 <0,001 |
| Воспалительные осложнения: прогрессирование и/или развитие гнойного холангита острый панкреатит | 8/5,3 5/3,3 3/2,0 | 27/12,9 13/6,2 14/6,7 | 0,019 0,011 0,008 |
| Прогрессирование печеночной недостаточности | 10/6,7 | 14/6,7 | 1,000 |
| Итого | 23/15,3 | 54/25,7 | 0,039 |
В 1й группе (технология раннего стентирования) осложнения диагностированы у 23 из 150 пациентов (15,3%), во 2й (технология отсроченного стентирования) — у 44 из 210 пациентов (21,0%), причем у 7 (16,0% от пациентов этой группы) наблюдалось более одного осложнения. Таким образом, количество осложнений во 2й группе составило 54. Различия между группами статистически значимы (p=0,039).
Наиболее часто встречались воспалительные осложнения, в том числе гнойные, в 1й группе их было статистически значимо меньше (p=0,019).
Частота прогрессирования полиорганной недостаточности после адекватно выполненной процедуры была одинаковой в обеих группах (p=1,000). Необходимо отметить, что такой исход наблюдался только у тяжелых больных с выраженной исходной печеночнопочечной недостаточностью: уровень билирубина крови — выше 200 ммоль/л, аспартатаминотрансфераза и аланинаминотрансфераза превышали норму более чем в 2,0±0,3 раза, креатинин сыворотки крови был выше нормы в 1,4±0,3 раза, мочевина — в 1,2±0,3 раза.
Летальность в течение 1 мес в 1й группе (4 из 150 больных, 2,6%) была статистически значимо ниже (p=0,038), чем во 2й (10 из 210 пациентов, 4,8%). Причиной гибели пациентов во всех случаях явилось прогрессирование полиорганной недостаточности, несмотря на адекватно выполненную декомпрессию желчных путей.
В настоящее время не вызывает сомнений, что механическая желтуха является наиболее тяжелым осложнением течения опухолевого процесса гепатопанкреатодуоденальной области и должна быть ликвидирована как можно быстрее от момента ее возникновения в связи с угрозой развития холангита, острого панкреатита и печеночной недостаточности [2, 4].
Отсутствие желчи в тощем кишечнике не позволяет восстановить равновесие его микрофлоры, прервать активацию токсинов и уменьшить явления интоксикации, которая, в том числе, определяет тяжесть состояния пациентов [2, 5]. Поступление желчи per os нельзя отнести к физиологическому: щелочное состояние желчи однозначно отрицательно влияет на слизистую оболочку пищевода и желудка [5, 8, 13].
Выполнение наружного дренирования без восстановления антеградного пассажа желчи в тонкий кишечник достигает главной цели процедуры — декомпрессии желчных протоков, но, согласно результатам нашего исследования, не приводит к радикальному улучшению результатов — уменьшению количества осложнений, прежде всего воспалительных, и снижению летальности.
При использовании в лечении раннего стентирования желчных путей фактически формируются два пути оттока желчи — наружный (по дренажному катетеру) и естественный, физиологичный (по восстановленным методом стентирования желчным протокам), что, согласно полученным данным, приводит к более быстрой декомпрессии желчных путей, обеспечивает эвакуацию «застойной» желчи, снижение явлений интоксикации, уменьшение летальности в ближайшем послеоперационном периоде.
Важность такого подхода определяется еще и тем, что обеспечивается естественное, близкое к физиологическому поступление желчи в кишечник, а это, в свою очередь, предупреждает дальнейшую активацию микрофлоры двенадцатиперстной кишки и разрывает порочный круг поддержания эндогенной интоксикации.
Тактика раннего стентирования может являться как окончательным вариантом лечения, так и этапом подготовки пациента к радикальной операции.
Заключение. Наиболее эффективным и безопасным вариантом помощи больным механической желтухой опухолевого генеза в остром периоде является декомпрессия желчных путей способом наружного чрескожного дренирования желчных путей и раннего стентирования желчных путей — в первые трое суток.
Технология раннего стентирования в сочетании с наружным дренированием обеспечивает восстановление антеградного (естественного) тока желчи, что позволяет быстрее достичь главной цели — декомпрессии желчных путей, а также обеспечить физиологичное поступление желчи в тонкий кишечник, избежать воспалительных «застойных» осложнений (холангит, панкреатит), в том числе и гнойных, значительно уменьшить явления эндогенной интоксикации, снизить летальность в ближайшем послеоперационном периоде.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какимилибо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Шевченко Ю.Л., Ветшев П.С., Стойко Ю.М. и др. Диагностика и хирургическая тактика при синдроме механической желтухи. Анналы хирургической гепатологии 2008; 13(4): 96–105.
- Ломакин И.А., Иванов Ю.В., Сазонов Д.В. и др. Диагностика и лечебная тактика у больных с механической желтухой. Клиническая практика 2012; 3: 42–50.
- Greenlee R.T., HillHarmon M.B., Murray Т., Thun M. Cancer statistics, 2001. Cancer J Clin 2001; 51: 15–36.
- Рыбачков В.В., Дряженков И.Г., Кабанов Е.Н. Причины эндогенной интоксикации при гнойном холангите. Анналы хирургической гепатологии 2009; 14(2): 28–32.
- Ахаладзе Г.Г. Гнойный холангит: вопросы патофизиологии и лечения. Consilium medicum 2003; 5: 4.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М: Видар; 2006; 559 с.
- Прокубовский В.И., Капранов С.А. Чреспеченочное эндопротезирование желчных протоков. Хирургия 1990; 1; 18–23.
- Kim H.J., Lee S.K., Kim M.H., Song M.H., Park D.H., Kim S.Y., et al. Percutaneous transhepatic cholangioscope treatment of patients with benign bilioenteric anastomotic strictures. Gastrointest Endosc 2003; 58(5): 733–738.
- Ветшев П.С., Стойко Ю.М., Левчук А.Л. и др. Возможности современных методов диагностики и обоснование лечебной тактики при механической желтухе. Вестник хирургической гастроэнтерологии 2008; 2: 24–32.
- Гусев А.В., Балагуров Б.А., Боровков И.Н. и др. Дренирование и эндопротезирование желчных протоков при механической желтухе. Вестник новых медицинских технологий 2008; 15(4): 97–98.
- Израилов Р.Е., Кулезнева Ю.В., Xатьков И.Е. и др. Роль интервенционной радиологии в малоинвазивном лечении больных с опухолями органов билиопанкреатодуоденальной зоны. Диагностическая интервенционная радиология 2011; 5(3): 37–43.
- Завражнов А.А., Попов А.Ю., Петровский А.Н. и др. Значение малоинвазивных методов декомпрессии желчных протоков в лечении больных с механической желтухой. Неотложная медицинская помощь 2012; 2: 54–58.
- Кулезнева Ю.В., Израилов Р.Е., Капустин В.И. Тактика антеградной билиарной декомпрессии у больных с механической желтухой опухолевого генеза. Вестник Национального медикохирургического центра им. Н.И. Пирогова 2010; 5(2): 24–28.
- Тулин А.И., Зерав С.Н., Купч С.К. Эндоскопическое и чрескожное чреспеченочное стентирование желчных протоков. Анналы хирургической гепатологии 2007; 12(1): 53–61.
- Шаповальянц С.Г., Будзинский С.А., Федоров Е.Д. и др. Эндоскопическое лечение послеоперационных рубцовых стриктур желчевыводящих путей (20летний опыт). Анналы хирургической гепатологии 2011; 16(2):10–17.
- Шевченко Ю.Л., Ветшев П.С., Стойко Ю.М. и др. Приоритетные направления в лечении больных с механической желтухой. Анналы хирургической гепатологии 2011; 3: 9–15.
