- A
- A
- A
- A
- A
- A
- Нормальный
- Увеличенный
- Большой
Сывороточное содержание растворимых молекул HLA I класса и HLA-DR у больных патологией шейки и тела матки
М.Е. Мамаева, зав. отделением гинекологии стационара №11; соискатель кафедры онкологии ФПКВ2;
С.В. Шумилова, к.б.н., научный сотрудник НИИ молекулярной биологии и регионарной экологии3;
Ж.А. Казацкая, к.б.н., старший научный сотрудник НИИ молекулярной биологии и регионарной экологии3;
М.В. Хазов, главный врач стационара №11;
В.В. Новиков, д.б.н., профессор, директор НИИ молекулярной биологии и регионарной экологии, зав. кафедрой молекулярной биологии и иммунологии3;
А.В. Алясова, д.м.н., профессор кафедры онкологии ФПКВ2
1 Приволжский окружной медицинский центр Федерального медико-биологического агентства России, Н. Новгород, 603005, Нижне-Волжская набережная, 2;
2 Нижегородская государственная медицинская академия, Н. Новгород, 603005, пл. Минина и Пожарского, 10/1;
3 Нижегородский государственный университет им. Н.И. Лобачевского — Национальный исследовательский университет, Н. Новгород, 603950, проспект Гагарина, 23
Цель исследования — оценить связь содержания растворимых молекул HLA I класса (sHLAI) и HLA-DR (sHLA-DR) в сыворотке крови больных патологией шейки и тела матки с видом патологии, степенью дифференцировки опухоли, количеством и локализацией миоматозных узлов.
Материалы и методы. Под наблюдением находились 142 женщины с патологией шейки и тела матки в возрасте 31–79 лет (медиана — 52 года). Сывороточный уровень молекул sHLAI и sHLA-DR определяли иммуноферментным методом с помощью моноклональных антител. Для получения образцов сыворотки использовали кровь, взятую из кубитальной вены. Все анализы выполнялись до начала лечения и после его окончания. Для проведения иммуноферментного анализа с целью выявления растворимых форм дифференцировочных молекул применяли мышиные моноклональные антитела.
Результаты. Установлено, что развитие злокачественной патологии шейки и тела матки и миом сопровождается повышением сывороточного уровня молекул sHLAI и sHLA-DR, степень которого зависит от вида патологии, диагностированной у больных опухолями шейки и тела матки и от степени дифференцировки аденокарциномы у больных раком тела матки, от количества и локализации миоматозных узлов. Исходная концентрация растворимых молекул HLA I класса и HLA-DR в предоперационном периоде может служить дополнительным диагностическим тестом у больных опухолями матки для последующего отбора таких пациентов с целью выполнения того или иного вида оперативного вмешательства.
Ключевые слова: растворимые молекулы HLA I класса и HLA-DR; sHLAI, sHLA-DR; рак шейки матки; опухоли тела матки; миомы; эндометриоз.
Для контактов: Мамаева Марина Евгеньевна, тел. моб. +7 910-382-91-37; e-mail: mamaevame@yandex.ru
Система главного комплекса гистосовместимости человека (HLA), обеспечивая регуляцию иммунного ответа, осуществляет такие важнейшие физиологические функции, как взаимодействие всех иммунокомпетентных клеток организма, распознавание своих и чужеродных, в том числе измененных собственных, клеток, запуск и реализацию иммунного ответа. Эта система в целом обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии [1]. Молекулы HLA I класса и HLADR могут находиться не только в мембранной форме, но и в растворимой (sHLAI и sHLADR), обнаруживаясь в сыворотке крови человека. Повышение уровня sHLAI в сыворотке крови описано у больных острой миелоидной лейкемией [2], злокачественными лимфомами [3], при ВИЧинфекции [4], поражениях печени различной этиологии [5, 6], ожоговой болезни [7]; понижение — при опухолях мозга, раке желудка, инсулинзависимом сахарном диабете [8], при одной из форм сифилиса [9]. Отмечено повышение уровня sHLADR в сыворотке крови больных ревматоидным артритом [10], при острой лимфобластной лейкемии [11], при ВИЧинфекции [4]. Однако в доступной литературе практически отсутствуют сведения о концентрации молекул sHLAI и sHLADR у больных патологией шейки и тела матки. В работе К.А. Коровушкиной [12] показано, что содержание молекул sHLAI при развитии миомы матки или рака эндометрия не меняется.
Цель исследования — оценить связь содержания растворимых молекул HLA I класса (sHLAI) и HLADR (sHLADR) в сыворотке крови больных патологией шейки и тела матки с видом патологии, степенью дифференцировки опухоли, количеством и локализацией миоматозных узлов.
Материалы и методы. Под наблюдением находились 142 женщины с патологией шейки и тела матки в возрасте 31–79 лет (медиана — 52 года). Среди них 53 пациентки (37%) получали лечение по поводу миомы матки, у 18 (13%) был диагностирован рак шейки матки (РШМ), у 65 (46%) — злокачественные опухоли тела матки, у 6 (4%) — эндометриоз. На основании клиникоинструментального обследования пациенток и с учетом постхирургической классификации РШМ и опухолей тела матки у 61 из 83 больных (73%) установлена I, у 17 (21%) — II, у 5 (6%) — III стадия заболевания. Диагноз во всех случаях был подтвержден гистологически путем патологоанатомического исследования послеоперационного материала. У больных РШМ во всех случаях был выявлен плоскоклеточный рак шейки матки. У больных опухолями тела матки, по данным гистологии, преобладала аденокарцинома — 50 (77%). Независимо от стадии и локализации опухолей зарегистрирована преимущественно высокая степень их дифференцировки — 32 случая (49%), реже встречались умереннодифференцированные (19, 29%) и низкодифференцированные (14, 22%) новообразования. Проведенное лечение зависело от стадии заболевания, гистологического типа строения опухоли и включало различные виды оперативных вмешательств, преимущественно экстирпацию матки с придатками — 79 человек (56%) или надвлагалищную ампутацию матки без придатков — 25 (18%). Значительно реже выполнялись такие операции, как консервативная миомэктомия — 17 (12%), надвлагалищная ампутация матки с придатками — 15 (10%) и экстирпация матки без придатков — 6 человек (4%). Контрольная группа была представлена 45 женщинами, не страдающими гинекологической патологией, сопоставимыми по возрасту с обследованными больными.
Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено Этическим комитетом НижГМА. От каждой пациентки получено информированное согласие.
Для получения образцов сыворотки использовали кровь, взятую из кубитальной вены. Для образования сгустка образцы крови последовательно выдерживали при температуре +37°С 30 мин в термостате и в холодильнике при температуре +4°С. После этого свернувшуюся кровь центрифугировали 15 мин при 200 g. Сыворотку собирали в сухие, чистые пластиковые микропробирки. Полученную сыворотку хранили при температуре –40…–60°С в холодильнике до 6 мес.
Все анализы выполнялись в динамике: до начала лечения и после его окончания. Для проведения иммуноферментного анализа с целью выявления растворимых форм дифференцировочных молекул применяли мышиные моноклональные антитела (МКА) серии ИКО (НИИ клинической онкологии, РОНЦ им. академика Н.Н. Блохина), продуцируемые гибридомами, полученными в Российском онкологическом научном центре им. Н.Н. Блохина РАМН (Москва). Определение уровня растворимых дифференцировочных молекул в сыворотке крови выполняли двухсайтовым иммуноферментным методом с использованием поликлональных антител в качестве подложки и моноклональных антител, конъюгированных с пероксидазой корня хрена. Учет результатов проводили при длине волны 492 нм спектрофотометрически с использованием фотометра "Мультискан ЕХ" (LabSystems, Финляндия). Результаты оценивали, переводя в условные единицы оптической плотности (U/ml).
Для обработки результатов использовали пакет статистических программ Statistica 6.0.
Результаты и обсуждение. Проведенные исследования показали различия в исходном содержании растворимых молекул HLA I класса и HLADR в сыворотке крови больных патологией шейки и тела матки и в группе женщин, не страдающих гинекологическими заболеваниями (табл. 1).
Таблица 1
Содержание растворимых молекул HLA I класса и HLA-DR в сыворотке крови больных патологией шейки и тела матки, U/ml
| Локализация опухоли | Растворимые молекулы HLA I класса | Растворимые молекулы HLA-DR |
| Рак шейки матки (n=18) | 2357,1±260,4* | 245,3±20,2* |
| Злокачественные опухоли тела матки (n=65) | 2147,88±204,89* | 184,39±34,13* |
| Миома матки (n=53) | 1751,6±148,3* | 196,0±14,4* |
| Эндометриоз (n=6) | 1277,6±210,5 | 123,7±21,0 |
| Контрольная группа (n=45) | 1012,0±214,0 | 99,5±18,4 |
* — различия значений статистически значимы при сравнении с контролем, р<0,05.
У больных РШМ уровень молекул sHLAI статистически значимо превышал его значения в контрольной группе — в 2,3 раза, уровень sHLADR — в 2,5 раза; при злокачественных опухолях тела матки — в 2,1 и 1,8 раза; при миомах матки — в 1,7 и 2,0 раза соответственно. У больных эндометриозом концентрация молекул sHLAI и sHLADR значимо не отличалась от соответствующих показателей в группе контроля.
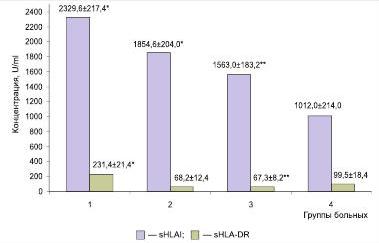
Развитие высокодифференцированных опухолей тела матки сопровождалось статистически значимым возрастанием уровня молекул sHLAI и sHLADR (в 2,3 раза по каждому показателю) по сравнению с контролем (рис. 1). В случаях умереннодифференцированных новообразований сохранялись значимые различия с группой здоровых лиц по уровню молекул sHLAI (в 1,8 раза), однако концентрация молекул sHLADR не отличалась от нормы и была значимо ниже (в 3,4 раза), чем у лиц, страдающих высокодифференцированными опухолями. В сыворотке больных опухолями, имеющими низкодифференцированное строение, содержание молекул sHLAI и sHLADR оставалось на уровне показателей здоровых лиц. Однако в условиях роста злокачественного новообразования отсутствие значимого повышения концентрации обоих типов молекул свидетельствовало не о состоянии благополучия организма, а об истощении функциональных возможностей иммунной системы на фоне развития наиболее агрессивно протекающего варианта заболевания.

Рис. 1. Содержание растворимых молекул HLA I класса и HLADR в сыворотке крови больных злокачественными опухолями тела матки в зависимости от степени дифференцировки опухоли: 1 — пациентки с высокодифференцированными аденокарциномами (n=32); 2 — пациентки с умереннодифференцированными аденокарциномами (n=19); 3 — пациентки с низкодифференцированными аденокарциномами (n=14); 4 — контрольная группа (n=45); * — различия статистически значимы при сравнении с контролем (р<0,05); ** — при сравнении с группой высокодифференцированных опухолей (р<0,05)
Известно, что продукт главного комплекса гистосовместимости человека — мембранная молекула HLA I класса — участвует в презентации фрагментированных до пептидов антигенов цитотоксическим Тлимфоцитам [13]. По данным А.К. Голенкова и соавт. [14], уровень sHLAI может рассматриваться в качестве интегрального критерия массы опухоли у больных хроническим лимфолейкозом и множественной миеломой. Все эти данные указывают на важную роль этой молекулы в канцерогенезе. Функциональная роль мембранной формы молекулы HLADR заключается в связывании фрагментов чужеродных клеточных белков, попадающих в клетку в результате эндоцитоза. Эта молекула участвует в представлении фрагментов чужеродного антигена CD4+ лимфоцитам с последующей активацией последних. Полагают [1], что молекулы sHLADR также участвуют в защите организма от чужеродного антигена, связь с которым индуцирует трансдукцию сигнала. Возможно, что отсутствие значимого увеличения уровня растворимых молекул HLA I класса и HLADR в ответ на формирование бластоматозного зачатка обусловливает формирование более агрессивно протекающей опухоли, имеющей худший прогноз. Напротив, новообразования, характеризующиеся относительно более благоприятным течением, сопровождаются значимым повышением экспрессии мембранных форм молекул HLA I класса и HLADR и, соответственно, более высокой концентрацией растворимых форм этих белков. Следует отметить, что концентрация молекул sHLAI и sHLADR у пациенток с опухолями низкой степени дифференцировки была статистически значимо ниже, чем соответствующие значения у пациенток с высокодифференцированными опухолями (в 1,5 и 3,4 раза). Однако возможна и обратная взаимосвязь — исходно более агрессивно протекающая опухоль оказывает более глубокое дискоординирующее действие на состояние иммунной системы больных, что проявляется, в частности, снижением концентрации в сыворотке крови этих пациенток растворимых молекул HLA I класса и HLADR.
Полученные данные показали, что изменения концентраций молекул sHLAI и sHLADR взаимосвязаны с локализацией у больных миоматозных узлов (рис. 2).
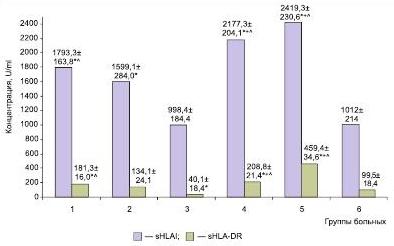
Рис. 2. Концентрация растворимых молекул HLA I класса и HLADR в сыворотке крови больных с различной локализацией миоматозных узлов: 1 — пациентки с преимущественно интерстициальной локализацией миоматозных узлов (n=8); 2 — пациентки с преимущественно интерстициальносубсерозной локализацией миоматозных узлов (n=15); 3 — пациентки с преимущественно серозной локализацией миоматозных узлов (n=12); 4 — пациентки с преимущественно интерстициальносубмукозной локализацией миоматозных узлов (n=9); 5 — пациентки с преимущественно субмукозной локализацией миоматозных узлов (n=9); 6 — контрольная группа (n=45); * — различия статистически значимы при сравнении с контролем (р<0,05); + — при сравнении с интерстициальносубсерозной локализацией (р<0,05); ^ — при сравнении с субсерозной локализацией (р<0,05)
У больных с субсерозной локализацией миоматозных узлов концентрация молекул sHLAI в сыворотке крови до лечения статистически значимо не отличалась от нормы. В случаях преимущественной интерстициальносубсерозной локализации узлов уровень молекул sHLAI превышал значения в контрольной группе в 1,6 раза (р<0,05). В группах больных, имеющих интерстициальную, интерстициальносубмукозную или субмукозную локализацию миоматозных узлов, наблюдалось значимое увеличение содержания молекул sHLAI (в 1,8; 2,2 и 2,4 раза соответственно) по сравнению с контролем.
При сравнении уровней молекул sHLAI в сыворотке крови больных с различной локализацией миоматозных узлов установлено, что в группах с преимущественно интерстициальносубсерозной и субсерозной локализацией новообразований статистически значимых различий не отмечалось. Однако у больных с преимущественно интерстициальной, интерстициальносубмукозной или субмукозной локализацией миоматозных узлов выявлено значимое увеличение содержания молекул sHLAI по сравнению с их уровнем в группе больных с преимущественно субсерозной локализацией опухоли (в 1,8; 2,2 и 2,4 раза соответственно). Кроме того, у больных с интерстициальносубмукозной или субмукозной локализацией новообразований отмечалось статистически значимое возрастание уровня молекул sHLAI по сравнению со сходным показателем у пациенток с преимущественной интерстициальносубсерозной локализацией миом (в 1,4 и 1,5 раза соответственно).
Содержание растворимых молекул HLADR у больных с интерстициальносубсерозной локализацией узлов не отличалось от нормы, а в случаях преимущественно субсерозной локализации новообразований статистически значимо снижалось по сравнению с контролем (в 2,5 раза). В случаях иной локализации узлов (интерстициальной, интерстициальносубмукозной или субмукозной) концентрация молекул sHLADR значимо превышала норму (в 1,8; 2,1 и 4,6 раза соответственно). Сохранялись различия в уровне молекул sHLADR в группах больных с различной локализацией новообразований, выявленные для измерения концентраций молекул sHLAI. В группах с преимущественно интерстициальносубсерозной и субсерозной локализацией узлов различий по содержанию молекул sHLADR не отмечалось. Но уровень этого белка возрастал у больных с интерстициальносубмукозной или субмукозной локализацией новообразований по сравнению с его значениями у пациенток с преимущественной интерстициальносубсерозной локализацией миом (в 1,6 и 3,4 раза) и в группах с интерстициальной, интерстициальносубмукозной или субмукозной локализацией миоматозных узлов по сравнению с концентрацией sHLADR молекул у пациенток с субсерозной локализацией опухоли (в 4,5; 5,2 и 11,5 раза соответственно).
Необходимо отметить, что у больных с преимущественно субсерозной локализацией новообразований наблюдался наиболее низкий уровень в сыворотке крови и молекул sHLAI, и молекул sHLADR. Вероятно, преимущественная субсерозная локализация миоматозного узла способствовала более значимым нарушениям иммунного ответа по сравнению с другими локализациями доброкачественных новообразований. Можно предположить, что выявленные отклонения уровня белков являются одним из факторов, определяющих своеобразие клинического течения того или иного варианта заболевания, поскольку они выступают в роли эндогенных иммуномодуляторов, принимая непосредственное участие в реализации иммунного ответа, отличающегося у больных с различными локализациями миоматозных узлов.
Были проанализированы различия в уровнях растворимых молекул HLA I класса и HLADR у больных с разным числом миоматозных узлов до лечения (рис. 3). В случае одного миоматозного узла наблюдалось возрастание (р<0,05) концентрации данных белков в 2,2 и 3,1 раза по сравнению с контролем. У больных с наличием 2–3 узлов содержание молекул sHLAI в 1,7 раза выше, чем у здоровых женщин, а содержание sHLADR не отличалось от показателя в контрольной группе. У пациенток, имевших 4–6 миоматозных узлов, уровни молекул sHLAI и sHLADR не отличались от нормы, но были значимо ниже, чем у лиц, имевших только один миоматозный узел (в 2,0 и 1,7 раза).
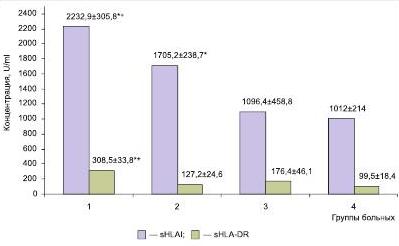
Рис. 3. Уровни растворимых молекул HLA I класса и HLADR у больных с различным числом миоматозных узлов: 1 — пациентки с наличием одного миоматозного узла (n=15); 2 — с наличием 2–3 миоматозных узлов (n=28); 3 — пациентки с наличием 4–6 миоматозных узлов (n=10); 4 — контрольная группа (n=45); * — различия статистически значимы при сравнении с контролем (р<0,05); + — при сравнении с группой с наличием 4–6 миоматозных узлов (р<0,05)
Выявленные изменения сывороточной концентрации тестированных белков, повидимому, отражают особенности иммунных реакций на разных этапах течения бластоматозного процесса. Рост доброкачественного новообразования сопровождался количественным изменением молекул sHLAI и sHLADR, особенно значимым на этапе формирования 4–6 миоматозных узлов. Возможной причиной такого явления может быть непосредственное вмешательство в продукцию растворимой формы антигена опухолевых клеток. Проведенные исследования [13, 15, 16] свидетельствуют о том, что опухолевые клетки экспрессируют на своей поверхности рецепторы, в норме свойственные иммунокомпетентным клеткам, и активно участвуют в иммунных реакциях, следствием чего является нейтрализация цитотоксических клеток, прежде всего Тлимфоцитов. Возможно, различие концентраций sHLAI и sHLADR молекул является одним из факторов, определяющих вероятность мультицентричности очагов поражения.
Выполнение оперативного вмешательства не оказывало значимого влияния на уровень растворимых молекул HLA I класса и HLADR независимо от вида выполненной операции (табл. 2). Однако концентрации растворимых белков, повышенные по сравнению с контролем в предоперационном периоде, у больных РШМ после выполнения оперативного вмешательства не отличались от нормы. Сходные изменения уровней молекул sHLAI и sHLADR отмечены у больных миомой матки в случаях выполнения консервативной миомэктомии. Обращали на себя внимание значимые различия показателей sHLAI и sHLADR молекул у женщин, которым в последующем была проведена консервативная миомэктомия или надвлагалищная ампутация матки с придатками. В последнем случае содержание молекул sHLAI в сыворотке крови было в 1,6 раза, а sHLADR — в 1,8 раза выше, чем в группе с консервативной миомэктомией. Показатели sHLADR молекул у больных, которым была впоследствии выполнена надвлагалищная ампутация матки без придатков, также были статистически значимо ниже (в 2,2 раза), чем соответствующие значения в предоперационном периоде у лиц, перенесших впоследствии надвлагалищную ампутацию матки с придатками. Представленные данные свидетельствуют о том, что тестирование больных патологией шейки и тела матки по уровню растворимых молекул HLA I класса и особенно по уровню молекул sHLADR может служить дополнительным диагностическим признаком для отбора пациентов с целью последующего выполнения того или иного вида оперативного вмешательства.
Таблица 2
Влияние вида хирургического лечения на изменение уровня растворимых молекул HLA I класса и HLA-DR у больных патологией шейки и тела матки

Заключение. Уровни растворимых молекул HLA I класса и HLADR взаимосвязаны с видом патологии, диагностированной у больных опухолями шейки и тела матки, со степенью дифференцировки аденокарциномы у больных раком тела матки, количеством и локализацией миоматозных узлов. Не установлено связи изменения уровней данных белков с видом выполненного оперативного вмешательства.
Исходная концентрация растворимых молекул HLA I класса и HLADR в предоперационном периоде может служить дополнительным диагностическим тестом у больных опухолями матки для последующего отбора таких пациентов с целью выполнения того или иного вида оперативного вмешательства.
Финансирование исследования. Работа выполнена в рамках НИР Н46399 Программы повышения конкурентоспособности ННГУ им. Н.И. Лобачевского.
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Хаитов Р.М., Алексеев Л.П. Физиологическая роль главного комплекса гистосовместимости человека. Иммунология 2001; 3: 4–12.
- Countini P., Zocchi M.R., Pierri I., Albarello A., Poggi A. In vivo apoptosis of CD8(+) lymphocytes in acute myeloid leukemia patients: involvement of soluble HLAI and Fas ligand. Leukaemia 2007; 21(2): 253–260, http://dx.doi.org/10.1038/sj.leu.2404494.
- Nocito M., Montalban C., GonzalesPorque P., Villar L.M. Increased soluble serum HLA class I antigens in patients with lymphoma. Hum Immunol 1997; 58(2): 106–111, http://dx.doi.org/10.1016/S01988859(97)002279.
- Khudiakova N.E., Novikov V.V., Kravchenko G.A., Ivanova N.I., Ptitsyna I.S., Nosov N.N. Soluble HLA class I and HLA class II antigens in the blood of HIV infected patients. Журнал микробиологии, эпидемиологии и иммунобиологии 2004; 1: 42–45.
- Кравченко Г.А., Новиков Д.В., Птицына Ю.С., Новиков В.В. Сывороточный уровень растворимых форм мембранных антигенов клеток иммунной системы у носителей маркеров вирусного гепатита G. Вопросы вирусологии 2005; 50(5): 19–22.
- Новиков В.В., Евсегнеева И.В., Караулов А.В., Барышников А.Ю. Растворимые формы мембранных антигенов клеток иммунной системы при социально значимых инфекциях. Российский биотерапевтический журнал 2005; 4(2): 100–105.
- Lebedev M.Ju., Vilkov S.A., Sholkina M.N., Krizhanova M.A., Novikov V.V., Vyasmina E.S., Baryshnikov A.Ju. Peripheral blood lymphocytes immunophenotype and serum concentration of soluble HLA class I in burn patients. Burns 2003; 29(2): 123–128, http://dx.doi.org/10.1016/S03054179(02)002450.
- Новиков В.В., Караулов А.В., Барышников А.Ю., Кравченко Г.А., Бабаев А.А., Гостюжова Е.А., Евсегнеева И.В. Особенности структурного состояния пула растворимых форм мембранных антигенов клеток иммунной системы. Молекулярная медицина 2009; 4: 27–33.
- Новиков В.В., Евсегнеева И.В., Караулов А.В., Барышников А.Ю. Растворимые формы мембранных антигенов клеток иммунной системы при социально значимых инфекциях. Сообщение 2. Исследование их роли при вирусных инфекциях. Российский биотерапевтический журнал 2005; 4(3): 131–145.
- Verbuggen L.A., Dumarey N., Van de Velde H. Soluble HLA–DR antigen levels in serum correlate with rheumatoid arthritis disease activity and the presence of disease — associated epitopes. Tissue Antigens 2000; 56(5): 436–440.
- Stevenson F.K., George A.J., Walters M.T., Hamblin T.J. Analysis of soluble HLA class II antigenic material in patients with immunological diseases using monoclonal antibodies. J Immunol Methods 1986; 86(2): 187–190.
- Коровушкина К.А. Сравнительная оценка биохимических и иммунологических показателей при доброкачественных и злокачественных опухолях женской половой сферы. Автореф. дис. … канд. биол. наук. Н. Новгород, 2010.
- Ярилин А.А. Основы иммунологии. М: Медицина; 1999; 608 с.
- Голенков А.К., Митина Т.А., Новиков В.В. и др. Клиническое значение растворимых молекул адгезии (sCD50–ICAM3), апоптоза (sCD95) и sHLA класса I при лимфопролиферативных заболеваниях. Российский биотерапевтический журн. 2002, 1: 60–64.
- Головизин М.В. Вмешательство раковых клеток в процессы созревания и селекции Тлимфоцитов как фактор опухолевой прогрессии. Иммунология 2001; 6: 4–10.
- Perenkov A.D., Novikov D.V., Sakharnov N.A., Alyasova A.V., Utkin O.V., Baryshnikov A.Yu., Novikov V.V. Heterogeneous CD38 expression in tumor tissues of patients with colorectal cancer. Molecular Biology 2012; 46(5): 705–709.
